这是全球癌症患者的福音,更是中国新药研发的里程碑:当地时间11月14日,美国食品药品监督管理局(FDA)宣布:中国企业百济神州自主研发的抗癌新药“泽布替尼”,以“突破性疗法”的身份,“优先审评”获准上市!
抗癌新药“泽布替尼”。图片来源:百济神州官网
泽布替尼与BTK蛋白复合物晶体结构示意图
由此,泽布替尼成为第一个在美获批上市的中国本土自主研发抗癌新药,改写了中国抗癌药“只进不出”的尴尬历史。
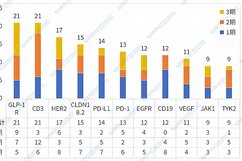
泽布替尼用于治疗既往接受过至少一项疗法的套细胞淋巴瘤(MCL)患者。目前,泽布替尼正作为单药或与其他疗法联合用药,在多种淋巴瘤治疗中开展临床试验。数据显示,在针对套细胞淋巴瘤的临床试验中,84%以上接受泽布替尼治疗的患者达到了总体缓解。泽布替尼的研发,历时7年。
据悉,这种药物未来几周内在美国进行销售。
网友评论:
研发背景
泽布替尼由百济神州的中国科学家团队独立研发,这款新型BTK抑制剂的药物设计旨在最大化对BTK靶点的特异性结合率,同时最大程度地减少脱靶效应。凭借其在一系列临床试验中展现的疗效与安全性,包括在套细胞淋巴瘤等多种B细胞恶性肿瘤中取得的研究数据,2019年1月,泽布替尼获得美国食品药品监督管理局(FDA)授予“突破性疗法认定”(Breakthrough Therapy Designation),用于治疗先前接受至少一次疗法的成年套细胞淋巴瘤(MCL)患者,从而成为首个在FDA获此认定的中国本土研发抗癌新药。
百济神州创始人、首席执行官兼董事长欧雷强先生表示:“我们致力于改善全球癌症患者的治疗,此次获批使我们更接近实现为全球患者带来最高质量药物的使命。紧接先前在这项适应症上获得的突破性疗法认定,今天泽布替尼获得FDA上市批准更是证明了其作为一项针对复发或难治性MCL治疗方案的重要性。我们将继续在其他血液肿瘤中对泽布替尼进行开发,也希望此次获批是为后续的众多上市批准首开先河。”
百济神州广州生产基地
在中国递交新药上市申请方面,百济神州表示,泽布替尼正在积极进行中,期望在明年上半年获批。若在中国获批,泽布替尼将在百济神州位于苏州桑田岛工业园区的小分子药物生产基地进行商业化生产。
另外,百济神州在广州的大分子生产基地1期工程已经于今年年10月30日在黄埔区、广州开发区宣布竣工。该基地总投资23亿元,占地面积10万平方米,专注于商业规模的大分子生物药工艺开发和生产。一期项目仅耗时两年即实现8000升生产能力,PD-1抗体替雷利珠单抗将在此生产。
三分之一的癌症可以预防,科学抗癌你得知道这些!
据国家卫健委疾控局,我国每年新发癌症病例超350万,死亡病例超200万,防控形势严峻。对于癌症你了解多少?如何分辨身体出现的癌症危险信号?哪些坏习惯最容易引发癌症?…戳图了解↓↓为你和家人的健康,请转发!











这药得多少钱一瓶啊