亿欧大健康6月7日消息,国家药监局(CDE)于今日发布了《中国新药注册临床试验进展年度报告(2021年)》,对2021年中国新药注册临床试验现状进行了全面汇总和分析。
据CDE官网介绍,本次年度报告主要根据2021年度登记的药物临床试验信息,从药物类型、品种及靶点特征、适应症、申办者类型、注册分类、试验分类、试验分期、特殊人群试验、临床试验组长单位、启动耗时和完成情况等角度对临床试验的总体趋势变化、主要特点、突出问题等进行汇总分析,同时对比近三年临床试验登记数据,对近年来的趋势特征进行总结分析。
从主要研究结果来看,2021年,药物临床试验登记与信息公示平台登记临床试验总量首次突破3000余项,较2020年年度登记总量增加29.1%。其中新药临床试验(以受理号登记的探索性和确证性临床试验)数量为2033项,较2020年登记量增加38.0%。
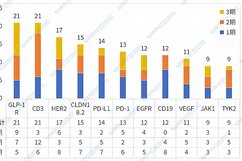
报告显示,在这3000余项临床试验中,化学药和生物制品的新药临床试验占比较高,年均分别为54.6%和40.4%。其中,创新药研发处于扎堆状态。近三年中,药物作用靶点主要集中在了PD-1和PD-L1,适应症则主要集中在抗肿瘤领域。报告指出,从试验分期分析,PD-1和PD-L1靶点Ⅲ期临床试验的比例亦高于其他靶点。再看中药,其近三年的临床实验主要集中在了呼吸、消化、心血管和精神神经4个适应症。
而受新冠疫情因素影响,2021 年新型冠状病毒灭活疫苗临床试验数量位居预防性疫苗类试验首位(20 项)。
报告指出,近三年临床试验分期占比趋势保持一致,均为Ⅰ期临床试验占比最高,2021年总体Ⅰ期临床试验占比为42.9%;近三年在特定人群中开展的临床试验均相对较少,仅在老年人群和儿童人群中开展的临床试验,分别不超过历年试验总体比例的0.2%和3%。罕见疾病药物主要以治疗神经系统疾病和血液系统疾病为主,临床试验数量和适应症领域均呈现逐年增加趋势。
以下为报告全文链接:
《中国新药注册临床试验进展年度报告(2021年)》