日前,入驻在海星医药健康创新园A区的北京因诺惟康医药科技有限公司(以下简称“因诺惟康”)自主研发的IVB103注射液提前收到美国食品药品监督管理局(FDA)的新药临床试验(IND)许可,可正式进入临床试验阶段。这是海淀区企业中第一个基因治疗的临床批件,也是北京市第一个自主研发创新载体的基因治疗临床批件。
据介绍,湿性黄斑变性是中老年人眼科常见及多发疾病,是中老年人致盲的第三大疾病。目前,湿性黄斑变性的一线疗法是玻璃体注射抗血管内皮生长因子(VEGF)的药物,该疗法最大的痛点是需要长期反复注射,会给病人带来眼痛和感染的风险,以及巨大的心理压力。
“我们自主研发的IVB103注射液,是在因诺惟康自主研发的新型载体基础上开发的一款可玻璃体内给药的,治疗新生血管性年龄相关性黄斑变性(又称“湿性黄斑变性”)和糖尿病黄斑水肿的药物。”因诺惟康CEO王成介绍道,目前,IVB103注射液临床试验申请还通过了国家药监局审评中心授理,获得临床批件后,因诺惟康将在中国率先开展临床试验。IVB103注射液的基因治疗有望一次玻璃体注射后终身有效,病人不再需要定期去医院注射抗VEGF药物,将极大程度地减轻患者的负担。
记者了解到,因诺惟康是一家以基因递送载体创新为驱动的临床阶段基因治疗公司,递送载体是基因治疗领域的关键技术。自成立以来,公司致力于开发适用于人体的基因治疗递送载体,解决递送载体开发中从动物到人转化困难的问题,目标找到所有组织和器官的基因递送载体,使基因治疗能够广泛应用到罕见疾病和常见疾病当中。目前已覆盖眼科、神经和肌肉等多个疾病领域,多个创新产品已经进入临床研究者发起的临床或者正式临床阶段。
此次IVB103注射液临床试验申请获批标志着因诺惟康正式成为一家临床阶段的生物技术公司,也标志着因诺惟康自主研发的递送载体初步获得国际监管机构的认可。未来,因诺惟康也将继续秉承初心,坚持以患者为中心,以科技为驱动,坚持源头创新临床转化,建设高素质的人才团队,全力以赴推动公司的研发进展和业务发展,开创基因治疗领域的美好未来。 (记者 阚丽丽)


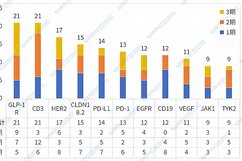









海淀药企太给力了!这新药有望一次注射就终身有效,简直是医学界的黑科技啊!